新藥研發(fā)發(fā)展態(tài)勢分析
中國網(wǎng)/中國發(fā)展門戶網(wǎng)訊 新藥研發(fā)集中體現(xiàn)了生命科學和生物技術(shù)前沿領(lǐng)域的新成就,是醫(yī)藥創(chuàng)新發(fā)展的關(guān)鍵環(huán)節(jié),是國際科技與經(jīng)濟競爭的戰(zhàn)略制高點。當前,前沿技術(shù)不斷革新、學科跨域融合、數(shù)字深度賦能,在基礎(chǔ)研究、轉(zhuǎn)化研究、應用研究等不同層面推動新藥研發(fā)領(lǐng)域取得重大進步,領(lǐng)域創(chuàng)新活躍,創(chuàng)新藥物密集上市。2023年,多款小分子藥物、抗體藥物、免疫細胞治療、基因治療與核酸藥物等獲批上市,新藥研發(fā)向提高創(chuàng)新質(zhì)量、回歸臨床價值等方向發(fā)展,我國新藥研發(fā)也進入快速發(fā)展階段。
技術(shù)革新、數(shù)據(jù)賦能驅(qū)動新藥研發(fā)快速發(fā)展
大數(shù)據(jù)與人工智能的融合,新技術(shù)新機制的快速突破,以及大型人群隊列研究范式的不斷推廣,正推動新藥研發(fā)領(lǐng)域的快速發(fā)展。
大數(shù)據(jù)、人工智能深度融合,改變藥物創(chuàng)新研究范式
大數(shù)據(jù)、人工智能技術(shù)等的融入,推動新藥研發(fā)領(lǐng)域?qū)崿F(xiàn)深刻變革。一方面,AlphaFold等模型革新了傳統(tǒng)生物大分子結(jié)構(gòu)預測和設(shè)計模式,助力候選新藥分子篩選產(chǎn)生巨大突破;另一方面,人工智能大幅縮短了新藥研發(fā)周期與成本,提升新藥研發(fā)效率,推動新藥研發(fā)多環(huán)節(jié)實現(xiàn)降本增效發(fā)展。至2023年底,全球已有100余個人工智能參與的藥物研發(fā)管線進入臨床試驗階段,覆蓋癌癥、神經(jīng)系統(tǒng)疾病、免疫系統(tǒng)疾病、腸道疾病、罕見病、心臟疾病和代謝性疾病等多個適應證。
新技術(shù)、新載體、新機制突破為新藥研發(fā)提供新動能
藥物的發(fā)現(xiàn)、遞送和穩(wěn)定等技術(shù)的不斷開發(fā)與迭代成熟,推動新藥研發(fā)進入快速發(fā)展階段。基因編輯技術(shù)推動新藥研發(fā)領(lǐng)域變革式發(fā)展,基因編輯治療已經(jīng)成為一種新藥類型,全球首例基于成簇規(guī)律間隔短回文重復序列(CRISPR)的基因編輯治療已于2023年獲批上市,為疾病帶來新型治療模式;以蛋白質(zhì)水解靶向嵌合體(PROTAC)為代表的靶向蛋白質(zhì)降解技術(shù)快速突破,有望解決“不可成藥”靶點和靶點突變導致的腫瘤耐藥性難題;核酸遞送技術(shù)和穩(wěn)定技術(shù)的提升,進一步推動小核酸藥物創(chuàng)新突破。
大型人群隊列為新型靶點發(fā)現(xiàn)和藥物創(chuàng)新提供新思路
大型人群隊列研究匯集了海量“全生命周期”健康大數(shù)據(jù)和生物樣本資源,已經(jīng)成為重要的開放性科研基礎(chǔ)設(shè)施和衛(wèi)生決策支撐平臺。基于大型人群隊列的高精度、高價值的數(shù)據(jù)資源,與人工智能技術(shù)相結(jié)合,可驅(qū)動發(fā)現(xiàn)一批新型生物標志物、藥物新靶點和新機制,極大地推動以數(shù)據(jù)密集、知識密集、腦力勞動密集為特征的新藥研發(fā)領(lǐng)域的研究和轉(zhuǎn)化。
新藥研發(fā)向提高創(chuàng)新質(zhì)量、回歸臨床價值發(fā)展
近年來,基因編輯技術(shù)、靶向蛋白質(zhì)降解技術(shù)、抗體偶聯(lián)技術(shù),以及核酸遞送技術(shù)和穩(wěn)定技術(shù)的發(fā)展,推動新藥研發(fā)向創(chuàng)新程度高、臨床優(yōu)勢突出、臨床價值顯著等方向發(fā)展。2023年,美國食品藥品管理局(FDA)藥品評價與研究中心(CDER)共批準55款新藥,包括38款新分子實體(包括34款新型小分子藥物和4款寡核苷酸藥物)和17款生物制品;相較于2022年的新藥批準數(shù)量增長了近50%,涉及小分子藥物、抗體藥物、核酸藥物等(圖1)。美國FDA還通過生物制品評價與研究中心(CBER)批準了16款新產(chǎn)品,包括5款基因治療、2款細胞治療、5款疫苗、1款微生物組療法,以及3款血液制品。
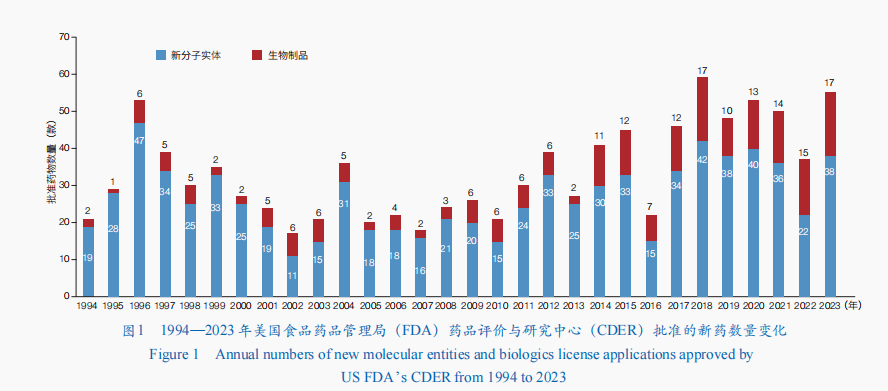
同時,中國國家藥品監(jiān)督管理局(NMPA)、歐洲藥品管理局(EMA)、日本藥品與醫(yī)療器械管理局(PMDA)、加拿大衛(wèi)生部(HC)、俄羅聯(lián)邦衛(wèi)生部(Minzdrav)、印度藥品管理總局(DCGI)等也批準了多款新藥上市。值得一提的是,2023年,全球首例基因編輯治療產(chǎn)品獲批上市,全球第2款核酸適配體(Aptamer)藥物也獲批,抗體藥物方面有4個新型雙特異性抗體上市,推動疾病治療手段更加多樣化。
小分子藥物仍占據(jù)新藥市場主流
小分子藥物能夠穿透細胞膜以靶向細胞內(nèi)蛋白,藥代動力學與藥效學特性更具預測性、高穩(wěn)定性,不具免疫原性,藥物開發(fā)流程與用藥方式相對簡單,因而仍占據(jù)創(chuàng)新藥物市場主流。尤其是近幾年共價抑制劑、靶向蛋白質(zhì)降解技術(shù)等的進步,以及模式創(chuàng)新為小分子藥物創(chuàng)新帶來更多發(fā)展機遇。
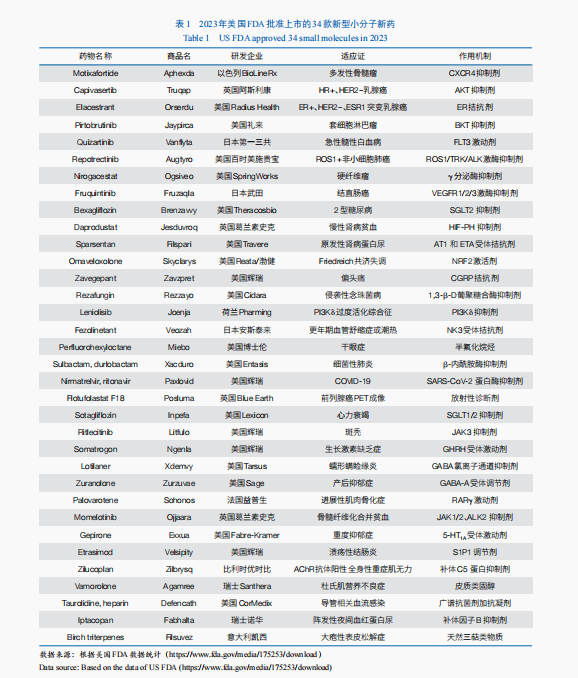
根據(jù)Nature Reviews Drug Discovery發(fā)布的數(shù)據(jù),自1994年以來在美國FDA批準的新藥中,小分子藥物占比約為60%,2023年美國FDA批準了34款新型小分子藥物(包括小分子化學實體,以及長度小于40個氨基酸的多肽)(表1)。2023年,多個“首款”小分子靶向藥物獲批上市。例如,雌激素受體拮抗劑Elacestrant獲批用以治療雌激素受體陽性(ER+)、人表皮生長因子受體2陰性(HER2–)、攜帶雌激素受體 1(ESR1)基因突變的晚期或轉(zhuǎn)移性乳腺癌;而BTK抑制劑Pirtobrutinib獲得美國FDA的加速批準,分別用于治療套細胞淋巴瘤與慢性淋巴細胞白血病或小淋巴細胞淋巴瘤。
抗體藥物研發(fā)與上市數(shù)量持續(xù)增加
抗體藥物是生物藥研發(fā)最快的領(lǐng)域之一,其研究和應用已發(fā)展至較成熟階段,全球抗體藥物市場持續(xù)增長。從全球抗體藥物審批情況來看,獲批產(chǎn)品數(shù)量整體呈增長趨勢,迄今已有173款抗體藥物獲批(圖2)。從適應證來看,腫瘤抗體藥物最多,占比近50%;其次為免疫相關(guān)疾病和神經(jīng)系統(tǒng)疾病。從細分類型來看,單克隆抗體藥物是抗體藥物開發(fā)的主要形式,技術(shù)也最為成熟——多款產(chǎn)品獲批應用于癌癥、自身免疫疾病等多種疾病的臨床治療;抗體偶聯(lián)藥物(ADC)、雙特異性抗體(BsAb)成為抗體藥物開發(fā)的新焦點,全球已有15款ADC藥物、13款BsAb藥物獲批。
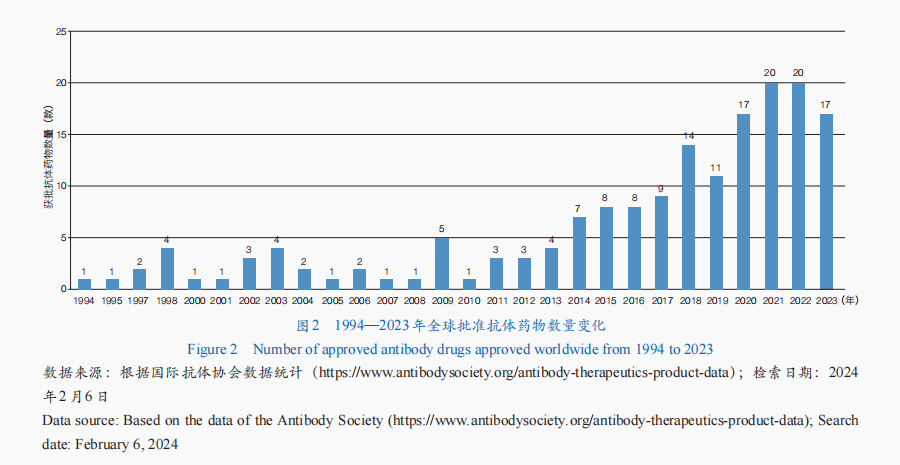
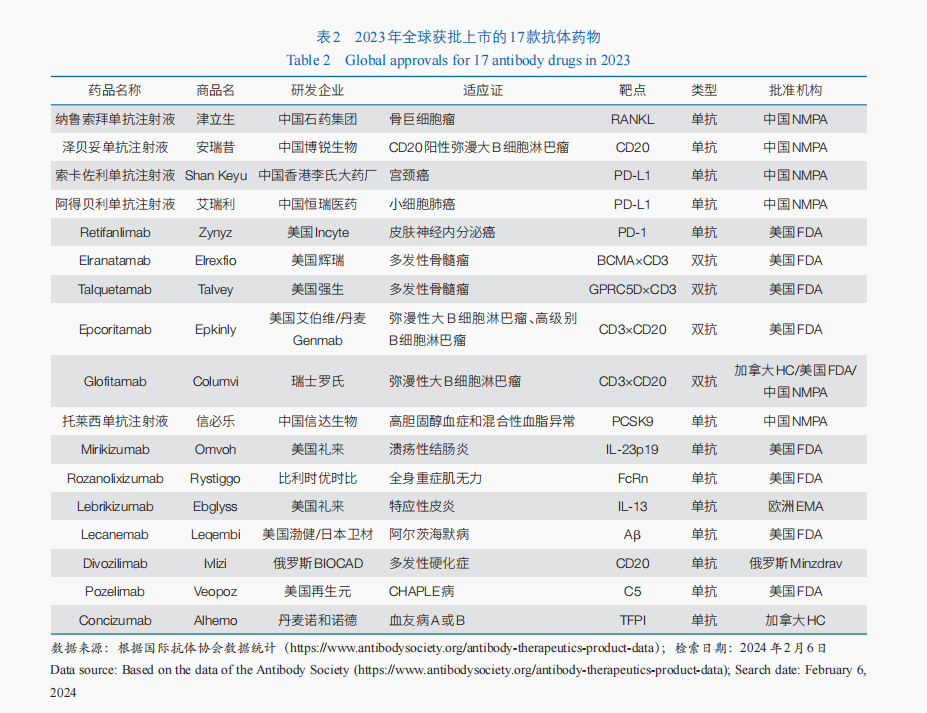
2023年,全球共有17款抗體藥物獲批(表2)。單克隆抗體藥物中,有3款屬于免疫檢查點抑制劑類藥物,包括美國FDA批準Retifanlimab用于治療皮膚神經(jīng)內(nèi)分泌癌;中國國家藥品監(jiān)督管理局批準了2款程序性死亡配體1(PD-L1)抑制劑,分別用于宮頸癌、小細胞肺癌的治療。BsAb中,2023年有4款雙特異性T細胞銜接器(BiTE)抗體藥物獲美國FDA批準用于血液腫瘤治療,包括治療復發(fā)/難治性彌漫性大B細胞淋巴瘤的2款雙抗藥物——Epcoritamab和Glofitamab,以及治療復發(fā)/難治性多發(fā)性骨髓瘤的2款雙抗藥物Talquetamab與Elranatamab。2023年雖然沒有ADC新藥獲批,但美國FDA批準了ADC藥物Enfortumab Vedotin與程序性死亡受體1(PD-1)抑制劑Pembrolizumab聯(lián)合療法,用于局部復發(fā)性或轉(zhuǎn)移性尿路上皮癌的一線治療,這也是該適應證首個獲批的PD-1+ADC聯(lián)合療法。
免疫細胞治療快速發(fā)展
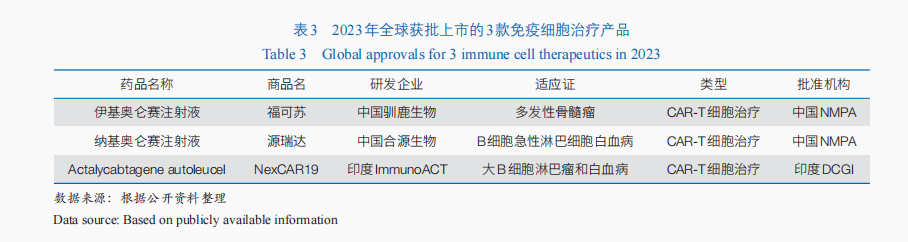
隨著免疫細胞治療技術(shù)的不斷成熟與臨床規(guī)范性的不斷提升,免疫細胞治療產(chǎn)品的臨床與轉(zhuǎn)化應用進程持續(xù)加快。截至2023年底,共有861款免疫細胞治療產(chǎn)品進入臨床試驗階段。其中,嵌合抗原受體T(CAR-T)細胞治療是當前免疫細胞治療的重要手段——全球開展的臨床試驗中,CAR-T細胞治療約占59.3%;2023年全球獲批上市的3款免疫細胞治療藥物均為CAR-T細胞治療產(chǎn)品(表3),迄今全球已有11款CAR-T細胞治療產(chǎn)品上市,均應用于血液腫瘤治療。同時,同種異體的通用型CAR-T細胞治療成為重要突破方向,全球首款通用型同種異體T細胞療法Tabelecleucel已于2022年12月獲歐洲EMA批準上市,用于治療愛潑斯坦·巴爾病毒(EBV)相關(guān)的移植后淋巴增殖性疾病。
除CAR-T細胞治療外,更具安全性的嵌合抗原受體自然殺傷(CAR-NK)細胞治療、具有實體瘤治療潛力的T 細胞受體嵌合T(TCR-T)細胞治療和腫瘤浸潤淋巴(TIL)細胞治療等均成為免疫細胞治療領(lǐng)域的研發(fā)熱點,多款產(chǎn)品進入上市申請階段。例如,治療晚期黑色素瘤的Lifileucel于2024年2月獲得美國FDA的加速批準,成為全球首款獲批上市的TIL細胞治療產(chǎn)品;治療晚期滑膜肉瘤的Afamitresgene autoleucel也已于2024年1月獲得美國FDA的優(yōu)先審評資格,有望成為全球首個獲批用于治療實體瘤的TCR-T 細胞治療產(chǎn)品藥物。
多款基因治療產(chǎn)品獲批上市
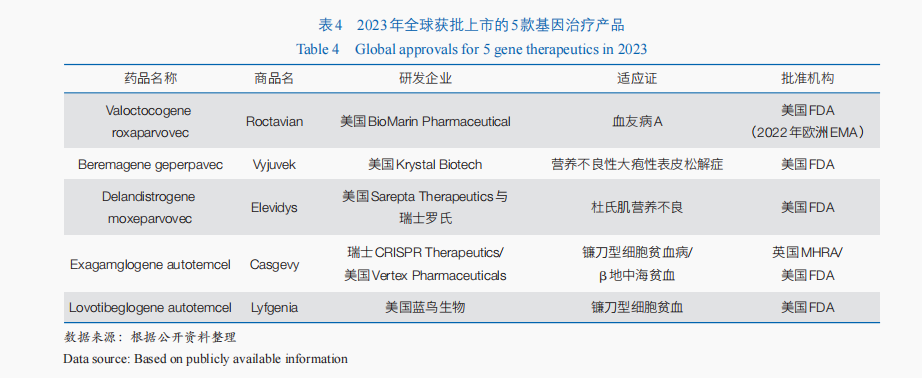
基因治療通過在基因水平上操縱或修飾細胞基因的表達來治療疾病,具有一次性治愈單基因遺傳病的潛力;目前,該方法主要用于遺傳性疾病的治療,也逐漸為癲癇、帕金森病、脊髓損傷等非遺傳性疾病治療提供了新的可能。隨著RNA干擾、CRISPR技術(shù)及mRNA(信使核糖核酸)核苷酸堿基修飾、載體遞送技術(shù)等新理論和新技術(shù)的出現(xiàn),其技術(shù)體系不斷拓展。從相關(guān)臨床試驗開展情況來看,近3年全球基因治療相關(guān)臨床試驗數(shù)量逐年增加,由2021年的43項增加到2023年71項,70%的臨床試驗仍處于臨床Ⅰ期或Ⅰ/Ⅱ期。從產(chǎn)品獲批情況來看,基因治療近年來產(chǎn)業(yè)化進程加速,迄今全球已有10余款基因治療產(chǎn)品上市,僅2023年美國FDA就通過CBER批準了5款基因治療產(chǎn)品(表4)。此外,以CRISPR為代表的基因編輯技術(shù)進一步為基因治療注入了新的活力。2023年,基于CRISPR技術(shù)的體外基因編輯治療迎來首個產(chǎn)品上市,用于鐮刀型細胞貧血病和β地中海貧血的治療。
RNA治療和疫苗走向應用
RNA治療和疫苗快速從臨床研究走向應用,多款產(chǎn)品相繼獲批上市。RNA治療種類多樣,主要包括反義寡核苷酸(ASO)、小干擾RNA(siRNA)、mRNA、Aptamer;另外,環(huán)狀RNA(circRNA)、轉(zhuǎn)移 RNA(tRNA)等也成為研發(fā)新方向。其中,以ASO和siRNA為代表的RNA藥物產(chǎn)業(yè)化進程加速。2023年,有4款小核酸藥物獲批上市,分別是美國渤健(Biogen)與伊奧尼斯制藥(Ionis)合作開發(fā)的ASO藥物Tofersen、丹麥諾和諾德(Novo Nordisk)針對1型原發(fā)性高草酸尿癥(PH1)的RNAi療法Nedosiran、日本安斯泰來(Astellas)的核酸適配體藥物Avacincaptad pegol,以及美國阿斯利康(AstraZeneca)/Ionis合作開發(fā)的ASO療法eplontersen(表5);全球累計已有19款產(chǎn)品獲批上市。針對傳染性疾病的預防性mRNA疫苗迅速推進,目前已有3款新冠mRNA疫苗獲批;針對流感病毒、呼吸道合胞病毒(RSV)、帶狀皰疹、巨細胞病毒、寨卡病毒、人類免疫缺陷病毒(HIV)、瘧疾和猴痘病毒開發(fā)的多款mRNA疫苗也正在進行臨床開發(fā)。

癌癥治療性疫苗是mRNA疫苗的下一個前沿領(lǐng)域。針對黑色素瘤、結(jié)直腸癌及頭頸癌、非小細胞肺癌、胰腺導管腺癌等實體瘤的多款mRNA腫瘤疫苗已進入臨床試驗階段。例如,美國莫德納(Moderna)公司開發(fā)的mRNA個體化癌癥疫苗mRNA-4157與美國默沙東(MSD)開發(fā)的PD-1抑制劑Pembrolizumab組合療法已于2023年進入Ⅲ期臨床,成為全球進展最快的mRNA癌癥疫苗;美國紀念斯隆凱·特琳癌癥中心(Memorial Sloan Kettering Cancer Center)和德國拜恩泰科(BioNTech)等開發(fā)的個體化mRNA疫苗BNT 112,通過與化療和免疫檢查點療法聯(lián)用治療胰腺導管腺癌,目前已開展Ⅱ期臨床試驗。
核酸適配體藥物進一步推進。全球第2款核酸適配體產(chǎn)品于2023年獲美國FDA批準用于治療年齡相關(guān)性黃斑變性(AMD)地圖狀萎縮(GA)。
核酸遞送技術(shù)和穩(wěn)定技術(shù)的提升進一步推動小核酸藥物創(chuàng)新突破。一方面,傳統(tǒng)脂質(zhì)納米顆粒(LNP)系統(tǒng)持續(xù)優(yōu)化,新型核酸遞送或修飾技術(shù)不斷開發(fā)。例如,新型親脂性siRNA偶聯(lián)物可實現(xiàn)向中樞神經(jīng)系統(tǒng)、眼及肺組織的安全有效遞送,還可通過抗體偶聯(lián)RNA、外泌體等多種方式來實現(xiàn)向不同組織器官的靶向遞送。另一方面,針對mRNA穩(wěn)定性差這一關(guān)鍵障礙,人工智能持續(xù)賦能。例如,百度公司等開發(fā)的算法LinearDesign可通過設(shè)計優(yōu)化mRNA序列顯著提高其穩(wěn)定性。此外,環(huán)狀RNA較線性mRNA穩(wěn)定性更好,有望成為下一代RNA藥物和疫苗的重點突破方向。
我國新藥研發(fā)進入快速發(fā)展階段
近年來,我國新藥研發(fā)和產(chǎn)業(yè)發(fā)展快速,國產(chǎn)新藥獲批數(shù)量和臨床試驗數(shù)量都呈現(xiàn)上升態(tài)勢,創(chuàng)新水平、臨床意義和價值也得到國際認可。當前,我國新藥研發(fā)已經(jīng)從“跟蹤仿制”走向“模仿創(chuàng)新”階段,正在向“原始創(chuàng)新”的新階段邁進,獲批新藥和臨床管線數(shù)量已位列全球第二梯隊。
國內(nèi)創(chuàng)新環(huán)境進一步優(yōu)化,國產(chǎn)創(chuàng)新藥進入收獲期
隨著帶量采購、一致性評價等醫(yī)藥政策的推進,仿制藥進入低利潤時代,從而倒逼中國藥企創(chuàng)新,進行轉(zhuǎn)型升級。同時,藥物審評審批制度、醫(yī)保支付等政策的改革持續(xù)深化,國內(nèi)創(chuàng)新環(huán)境進一步優(yōu)化,高臨床價值的創(chuàng)新產(chǎn)品不斷推出。
我國批準的藥物數(shù)量穩(wěn)步增長。2023年度國家藥品監(jiān)督管理局批準了40款創(chuàng)新藥,包括19款化學藥品、16款生物制品(含14款治療性生物制品、2款預防用生物制品)和5款中藥。
從獲批的創(chuàng)新藥類型來看,包括多款小分子化學藥,以及中藥、單克隆抗體、免疫細胞治療、抗體偶聯(lián)藥物、疫苗等。其中,免疫細胞治療備受關(guān)注。2023年有2款免疫細胞治療產(chǎn)品獲得附條件批準上市,包括:伊基奧侖賽注射液用于治療成人復發(fā)/難治性多發(fā)性骨髓瘤,這是全球首個全人源BCMA CAR-T細胞治療藥物;納基奧侖賽注射液用于治療成人復發(fā)/難治性B細胞急性淋巴細胞白血病,成為首個具有中國全自主知識產(chǎn)權(quán)的CD19 CAR-T細胞治療產(chǎn)品。2024年3月,科濟藥業(yè)靶向BCMA的CAR-T細胞治療產(chǎn)品澤沃基奧侖賽注射液獲國家藥品監(jiān)督管理局批準上市,用于治療成人復發(fā)或難治性多發(fā)性骨髓瘤。以上獲批上市的產(chǎn)品加上2021年獲批的2款CD19靶向的CAR-T細胞產(chǎn)品阿基侖賽注射液和瑞基奧侖賽注射液,迄今我國共有5款CAR-T細胞治療產(chǎn)品獲批上市。
國產(chǎn)創(chuàng)新藥廣受國際認可,邁入“出海”新階段
2019年以來,優(yōu)質(zhì)國產(chǎn)創(chuàng)新藥不斷獲得國際認可,在拓展海外市場方面已取得多項里程碑進展。百濟神州研發(fā)的抗腫瘤靶向藥澤布替尼膠囊于2019年經(jīng)美國FDA批準進入美國市場以來,在美國市場銷售額快速增長;2023年該藥國內(nèi)外總銷售額已超過10億美元,成為我國第一個“重磅炸彈”式的藥物。2023年是中國創(chuàng)新藥“出海”大年,多款新藥成功獲得批準進入歐美市場。2023年9月,百濟神州的替雷利珠單抗注射液獲得歐盟上市批準,成為我國首款成功“出海”的國產(chǎn)PD-1抑制劑藥物;君實生物PD-1抑制劑特瑞普利單抗注射液,成為獲美國FDA批準上市的首個中國自主研發(fā)和生產(chǎn)的創(chuàng)新生物藥;和黃醫(yī)藥原創(chuàng)并獨家許可給日本武田制藥的小分子抗腫瘤新藥呋喹替尼也獲得美國FDA批準,以用于治療經(jīng)治轉(zhuǎn)移性結(jié)直腸癌,這是中國首個從藥物發(fā)現(xiàn)到臨床開發(fā)均在本土自主完成的抗腫瘤藥物;億帆醫(yī)藥自主研發(fā)的第三代白細胞生長因子艾貝格司亭α注射液獲美國FDA批準上市,標志著國際對我國新藥研發(fā)、臨床、生產(chǎn)和質(zhì)量體系的認可。
繼PD-1抑制劑類國產(chǎn)創(chuàng)新藥“出海”之后,國產(chǎn)ADC藥物也開始走向國際市場。ADC藥物兼具小分子化療藥物的強殺傷效應和抗體藥物的腫瘤靶向性的雙重優(yōu)勢,國內(nèi)企業(yè)紛紛布局;至2023年底,在中國開展的ADC藥物臨床試驗超過1000項。近年來,我國生物醫(yī)藥研發(fā)創(chuàng)新成果對外授權(quán)(license-out)總額快速上升,2023年合同總金額達到400多億美元;其中,ADC藥物占200多億美元,百利天恒一家轉(zhuǎn)讓合同金額就達84億美元,這預示著我國ADC技術(shù)和產(chǎn)品受到國際關(guān)注與認可。
靶點扎堆和同質(zhì)化比較嚴重,藥物創(chuàng)新生態(tài)仍需繼續(xù)完善
近10多年來,我國新藥研發(fā)為了降低開發(fā)風險,出現(xiàn)了熱門靶點扎堆研發(fā)和臨床在研管線同質(zhì)化競爭現(xiàn)象。從某種意義上說,我國正處于從“跟蹤仿制”走向“模仿創(chuàng)新”的高速發(fā)展階段,這種情況難以完全避免。據(jù)統(tǒng)計,全球新藥研發(fā)布局前十大熱門靶點的集中度為7.68%,我國則已達到19.38%。新藥研發(fā)周期長、投入大,而同質(zhì)化競爭不利于后續(xù)的市場回報。
新藥研發(fā)同質(zhì)化一定程度上反映了我國基礎(chǔ)研究能力的薄弱,原始創(chuàng)新知識供給與轉(zhuǎn)化不足,可供轉(zhuǎn)化應用的成果和重大技術(shù)突破不多。一方面,對早期的基礎(chǔ)研究支持力度不夠?qū)е略夹詣?chuàng)新突破不足,自主發(fā)現(xiàn)的藥物作用新靶點、新機制和在此基礎(chǔ)上開發(fā)的新藥仍然較少;另一方面,也反映出許多基礎(chǔ)研究成果仍停留在論文上,向產(chǎn)業(yè)的轉(zhuǎn)化應用明顯不足。因而,加強原始創(chuàng)新、提升開辟新賽道的能力,成為我國新藥研發(fā)新階段的當務之急。
對我國新藥研發(fā)的啟示與建議
近幾年,我國新藥研發(fā)能力顯著提升,新藥獲批數(shù)量逐步增長,但仍存在基礎(chǔ)研究力度不夠、轉(zhuǎn)化能力弱、創(chuàng)新生態(tài)系統(tǒng)不夠完善等問題,制約了我國藥物的創(chuàng)新發(fā)展。因此,我國要不斷完善藥物創(chuàng)新體系定位和布局,推動新藥研發(fā)領(lǐng)域的發(fā)展。
加大基礎(chǔ)研究力度、關(guān)注前沿突破,開拓新藥研發(fā)新方向。生命科學和生物技術(shù)前沿的基礎(chǔ)研究,不僅孕育新藥發(fā)現(xiàn)的突破口,也不斷更新藥物研發(fā)理念,創(chuàng)造醫(yī)藥產(chǎn)業(yè)的新形式、新業(yè)態(tài)。目前,基礎(chǔ)研究薄弱、缺乏原始創(chuàng)新突破和核心技術(shù)是制約我國新藥研發(fā)和醫(yī)藥產(chǎn)業(yè)發(fā)展的重要原因。因此,我國相關(guān)科研院所及企業(yè)應密切關(guān)注基礎(chǔ)研究的新趨勢和新成就,主動對接科技前沿新突破,掌握創(chuàng)新引領(lǐng)的主動權(quán),逐步從模仿創(chuàng)新轉(zhuǎn)變?yōu)樵谀承┓较蛏系脑紕?chuàng)新。
深化多學科、多技術(shù)的交匯融合,推動新藥研發(fā)的變革式發(fā)展。當前,藥物化學、藥理學、信息科學、技術(shù)科學等學科之間的界限日益模糊,多學科綜合集成的趨勢不斷增強,學科交叉、技術(shù)集成已成為當代科技發(fā)展的強大推動力。因而,我國相關(guān)科研院所及企業(yè)應持續(xù)深化和應用生命科學、物質(zhì)科學和工程科學的最新知識、方法和技術(shù),充分通過多學科、多技術(shù)的交叉和融合促進藥物研發(fā)的變革。
瞄準國際前沿、發(fā)揮我國特色,實現(xiàn)部分領(lǐng)域的引領(lǐng)發(fā)展。一方面,在政策布局上,建議我國政府部門既要瞄準國際科技前沿、緊抓國際生物醫(yī)藥發(fā)展趨勢進行部署,逐步爭取在部分領(lǐng)域?qū)崿F(xiàn)引領(lǐng)發(fā)展;另一方面,要立足中國實際,充分發(fā)揚我國在中藥和天然藥物研究領(lǐng)域的優(yōu)勢和特色,不斷在特色領(lǐng)域取得新突破。
持續(xù)完善新藥監(jiān)管審評機制,推動產(chǎn)業(yè)高質(zhì)量發(fā)展。科學的藥物監(jiān)管體系是促進藥物高質(zhì)量發(fā)展的重要保障。因而,建議我國政府相關(guān)部門把嚴格監(jiān)管、確保安全和促進創(chuàng)新、推動發(fā)展放在同等重要的地位。通過持續(xù)深化審評審批制度改革,創(chuàng)新臨床試驗審批程序、藥物上市審評制度、醫(yī)療保障體系等藥物監(jiān)管體系建設(shè),加快臨床急需新藥、罕見病用藥、兒童用藥等上市和臨床應用,完善藥品定價和支付機制,推動產(chǎn)業(yè)高質(zhì)量發(fā)展。
(作者:徐萍,中國科學院上海營養(yǎng)與健康研究所 中國科學院大學;許麗、楊若南、李偉,中國科學院上海營養(yǎng)與健康研究所;陳凱先,中國科學院上海藥物研究所。《中國科學院院刊》供稿)












